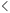近日,国家药品监督管理局信息中心、食品药品审核查验中心公开征求《疫苗生产检验电子化记录技术指南(征求意见稿)》(以下简称《指南》)意见。
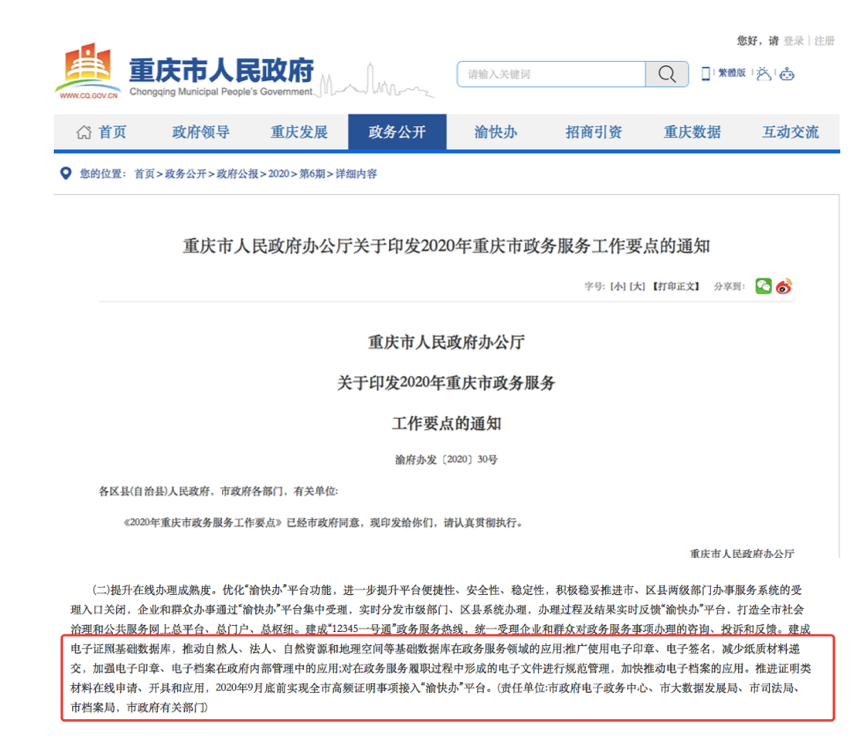
文件强调要在疫苗生产、包装、入库、放行、质量管理、电子数据采集/输入等多个环节应用电子签名,推动疫苗生产、检验信息的电子数据转化。
《指南》中有关如何在疫苗生产检验的各个环节进行电子签名应用,详细内容如下:
生产过程信息化要求
1、生产过程中
电子批记录的生产部分至少要包含以下内容:
[3] 每一生产工序的负责人的电子签名;
[4] 生产步骤操作人员的电子签名;必要时,还应当有操作(如称量)复核人员的电子签名;
[7] 中间控制结果的电子记录以及操作人员的电子签名;
[9] 对特殊问题或异常事件的电子记录,包括对偏离工艺规程的偏差情况的详细说明,并经授权人员的电子签字批准。
2、生产结束后
应当使用信息化手段记录清场操作,清场电子记录内容包括:操作间编号、产品名称、批号、生产工序、清场日期、检查项目及结果、清场负责人及复核人电子签名。清场电子记录应当纳入电子批生产记录。
3、包装操作
电子批包装记录至少要包含以下内容:
[3] 包装操作负责人的电子签名;
[4] 包装工序的操作人员的电子签名;
[7] 检查记录、中间控制结果的电子记录以及检查人员的电子签名;
检验过程信息化要求
5、疫苗放行管理理
根据物料和产品批准放行的操作规程,在电子检验报告单或产品审核报告单等文件中给与明确的结论,如批准放行、不合格或其他决定,并根据放行的职责进行电子签名。经可靠的电子签名后的电子检验报告单与纸质检验报告单具有同等法律效力。
质量管理信息化要求
6、质量文件管理
建议对于文件的起草、修订、审核和批准的相关操作,采用电子签名,并注明日期。
信息化基本要求
7、电子数据的采集/输入
[1] 关键数据应该仅由经过授权的人员录入,必要时进行电子签名,系统应该记录录入的详细信息、录入人身份和录入时间。
[4] 对录入数据的修改应该产生审计追踪,提供修改痕迹查询,包括数据的旧值与新值、修改时间、修改人及修改人的电子签名。审计追踪需由经过适当授权的独立人员进行审核。
在疫情与政策的双重作用下,药企数字化转型已成当务之急,而电子签名凭借“不见面、无接触、全线上”等数字化优势,可以保障医药行业业务安全、高效运作,助力行业企业数字化转型升级。
傲雄在线作为国内原笔迹电子签名开创者,拥有笔迹AI核心专利技术,致力于为政企提供全场景证据化签署服务,所打造的电子签名服务系统不仅安全合规、而且方便高效,不受任何场景空间限制,可确保业务过程中每个关键环节签名的唯一性、可追溯、无篡改,现已在政务、公安、检察院、银行、建筑、医疗等多个领域广泛应用,服务人群上亿。